김혜성 이사장(서울치대 졸업, 동대학원 박사)
사과나무의료재단의 이사장이자, 재단 산하 의생명연구소의 미생물 연구자이다.
구강미생물에서 시작해 장내 미생물, 발효 음식의 미생물까지 폭넓게 공부하며 몇 권의 책을 냈고 논문을 발표했다.
『미생물과의 공존』 『입속에서 시작하는 미생물이야기』 『미생물과 공존하는 나는 통생명체다』등 3권이 과학기술부 선정 우수과학도서를 수상했다.
암은 무섭습니다. 그중에서도 췌장암은 특히 무섭습니다. 췌장암으로 진단받으면 93% 정도가 5년 안에 사망한다고 합니다.(Fan, Alekseyenko et al. 2018) 조기발견이 어렵고, 공격성이 크기 때문이죠. 제 주위에도 췌장암으로 돌아가신 분이 있습니다.
모든 암이 그렇듯, 췌장암도 최종적으론, 조직검사를 통해 확진됩니다. 그런데, 조직을 떼려면, 췌장까지 들어가야 하니 그 전에 복부 CT 등으로 관찰하기도 합니다. 하지만, 이 역시 조영제를 먹고 CT를 찍어야 하는 복잡함이 있습니다. 좀 더 간단하게 조기 검진할 수는 없을까요.
췌장암의 조기진단을 위해 늘 건강의 위험요소로 등장하는 비만과 당뇨를 포함해 다양한 탐색이 이뤄지고 있습니다. 그중에서 현재까지 많이 거론되는 췌장암 진단표지자(biomarker)로 CA 19-9가 가장 많이 거론되는 듯합니다.(https://m.blog.naver.com/kimyhkimyh/220500366868)
검사의 정확도를 따질 때 쓰이는 CA 19-9의 민감도(sensitivity)는 80%, 특이도(specificity)는 90% 정도입니다. 민감도란 정말 암이 있는 환자를 암이 있다고 진단해 줄 수 있는 능력을 말하고, 특이도는 암이 없는 사람은 없다고 판단해 줄 수 있는 능력을 말합니다. 혈액검사에서 CA 19-9가 일정 수준 이상이면, 80% 정도 췌장암일 가능성이 크다는 것이고, 그래서 조직검사를 포함한 확진 검사가 요구된다는 의미입니다.
80% 정도의 이 수치를 좀 더 올려 진단의 정확도를 올리는 방법은 없을까요? 있습니다. 미생물, 그중에서도 구강미생물입니다. 혈당을 낮추는 인슐린을 분비하기도 하고, 하루 1리터의 소화효소를 만들어 소장에 쏟아내는 췌장은 소화기관으로 분류됩니다.
그리고, 구강부터 항문에 이르는 소화관은 우리 몸에서 미생물이 가장 많이 서식하는 곳입니다. 또 내 몸에 사는 미생물이 치주질환이나 장염과 같은 여러 질병의 시작과 진행에 관여할 수 있다는 것 역시 쉽게 유추가 됩니다. 그래서, 췌장암과 미생물에 대한 탐색이 시작되었고, 가장 먼저 지목된 미생물은 위암과 위궤양을 일으킨다는 유명한 헬리코박터 파이로리(H.pylori)였습니다. 하지만, 연구자들은, 파이로리와 췌장암의 연관에서 일관성 있는 결과를 만드는데 실패했습니다.(Michaud and Izard 2014)
그래서, 눈을 돌린 곳이 구강입니다. 구강역시 많은 미생물, 특히 음험한 병적 미생물의 저장고로 꼽혀왔기 때문이지요. 가장 최근의 연구는 미국 암예방협회에서 진행한, 비교연구입니다. 361명의 췌장암 환자와 371명의 건강한 사람의 타액 미생물을 비교했더니, Porphyromonas gingivalis와 AA( Aggregatibacter actinomycetemcomitans)를 가지고 있는 사람들이 췌장암에 걸릴 확률이 2배 정도 높았습니다.
이 두 세균은 오랫동안 치주질환을 일으키는 가장 중요한 세균으로 지목되어 왔지요. 또 Leptotrichia라는 세균을 가지고 있으면 상대적으로 췌장암에 걸릴 가능성이 낮았습니다. (Fan, Alekseyenko et al. 2018) 이 논문이 실린 Gut라는 학술지는 소화기 내과에서 가장 권위가 있는 저널 중 하나로 꼽힙니다.
좀 더 인상적인 연구도 있습니다. 이 역시 학술지 Gut에 실리며 주목을 받았는데요, 췌장암 환자와 건강한 사람의 타액 내 구강미생물을 비교했더니, Neisseria elongata 와 Streptococcus mitis가 췌장암 진단의 표지자(biomarker)로 쓰일 수 있다는 것입니다.
췌장암이 있는 사람과 건강한 사람들이 타액에서 이 두 세균의 검출 정도가 확연히 구분되어서입니다. 이 두 세균을 가지고 췌장암을 진단할 수 있는 민감도는 96.4%, 특이도는 82.1% 에 이릅니다. 이 정도면 최소한 현재 가장 많이 거론된다는 CA 19-9 보다 정확도가 높습니다.(Farrell, Zhang et al. 2012)
그럼, 구강미생물이 거리가 먼 췌장암까지 만들 수 있는 이유가 뭘까요. 모든 과학적 연관이 그렇듯이, 현재 가능성 정도를 놓고, 여러 방면으로 찾고 있는 중입니다. 그 내용을 최근 저널인 Fan 등(Fan, Alekseyenko et al. 2018)의 얘기로 정리해 보면, 첫째, 구강 미생물이 혈류를 타고 췌장에 도착해 문제를 일으킨다는 것. 잇몸병이 있으면 양치할 때 피가 나고, 우리가 꼭 피 나는 것을 의식하지 않더라도 칫솔질이나 심지어 밥 먹을 때도 구강미생물은 혈류를 침투할 수 있습니다.
실제로 구강미생물은, 췌장의 도관에 끼어있는 플라크에서도 발견되니까요.
둘째, 구강미생물 중 특히 P. gingivalis의 독특한 능력입니다. 진지발리스는 인간의 면역세포를 피해 다닙니다. 설사 이 녀석이 혈류에 침투해 있다고 하더라도, 췌장까지 도달하려면, 또 췌장에서 문제를 일으키는 동안 인간의 면역세포는 그 녀석을 감지하고 대처할 텐데. 그걸 피해 다닌다는 것입니다.(evasion of immune system)
셋째, 게다가 진지발리스는 AA나 다른 세균들과 협업하여 문제를 일으킵니다. 원래 세균이 살고 있는 구강이나 췌장 같은 데서, 세균이 있다고 하더라도, 바로 문제를 만들지는 않습니다. 세균들도 내 몸을 서식처 삼아 나름의 공동체를 갖고 살고, 그게 내 몸에 문제를 일으키려면 일정한 집단(Biofilm)을 이뤄야 하는데, 진지발리스가 나타나면 원래 있던 세균들의 공동체에 균열이 생깁니다.
그래서 원래 살고 있던 다른 세균들의 공동체를 헤집어, 세균총의 불균형(dysbiosis)을 가져오고, 그래서 질병을 만든다는 것입니다. 실제로 진지발리스의 이런 위험한 능력은 다른 여러 연구에서도 확인되어, 심지어 어떤 학자들은, 진지발리스를 구강미생물 군집의 선동가(community activist)로 비유하기도 합니다. (Darveau, Hajishengallis et al. 2012)
여하튼, 결론적으로 채취하기도 간단한 구강미생물이 저 안쪽의 위험한 췌장암을 조기 진단하는데 사용할 수 있는 날이 점점 가까이 오고 있습니다.(Archibugi, Signoretti et al. 2018) 더불어 구강위생관리의 중요성이 더욱 커지고 있고요.
Archibugi, L., et al. (2018). "The Microbiome and Pancreatic Cancer: An Evidence-based Association?" Journal of clinical gastroenterology 52: S82-S85.
Darveau, R., et al. (2012). "Porphyromonas gingivalis as a potential community activist for disease." Journal of Dental Research: 0022034512453589.
Fan, X., et al. (2018). "Human oral microbiome and prospective risk for pancreatic cancer: a population-based nested case-control study." Gut 67(1): 120-127.
Farrell, J. J., et al. (2012). "Variations of oral microbiota are associated with pancreatic diseases including pancreatic cancer." Gut 61(4): 582-588.
Michaud, D. S. and J. Izard (2014). "Microbiota, Oral Microbiome, and Pancreatic Cancer." Cancer journal (Sudbury, Mass.) 20(3): 203-206.
Wei, M.-Y., et al. (2019). "The microbiota and microbiome in pancreatic cancer: more influential than expected." Molecular Cancer 18(1): 97.
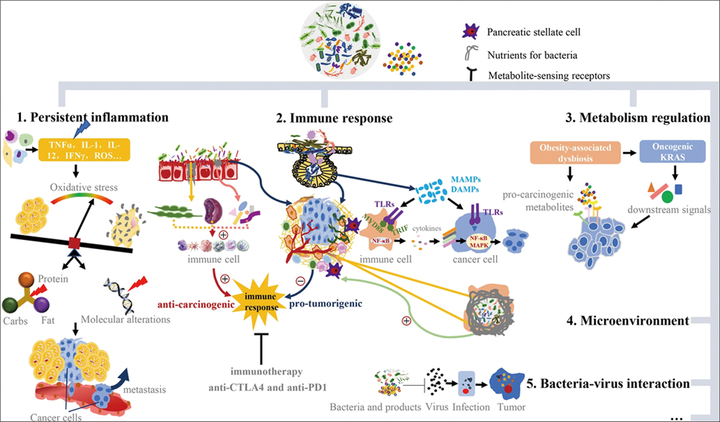
Microbiota is just beginning to be recognized as an important player in carcinogenesis and the interplay among microbes is greater than expected. Pancreatic ductal adenocarcinoma (PDAC) is a highly lethal disease for which mortality closely parallels incidence. Early detection would provide the best opportunity to increase survival rates. Specific well-studied oral, gastrointestinal, and intrapancreatic microbes and some kinds of hepatotropic viruses and bactibilia may have potential etiological roles in pancreatic carcinogenesis, or modulating individual responses to oncotherapy. Concrete mechanisms mainly involve perpetuating inflammation, regulating the immune system-microbe-tumor axis, affecting metabolism, and altering the tumor microenvironment. The revolutionary technology of omics has generated insight into cancer microbiomes. A better understanding of the microbiota in PDAC might lead to the establishment of screening or early-stage diagnosis methods, implementation of cancer bacteriotherapy, adjustment of therapeutic efficacy even alleviating the adverse effects, creating new opportunities and fostering hope for desperate PDAC patients.