김혜성 이사장(서울치대 졸업, 동대학원 박사)
사과나무의료재단의 이사장이자, 재단 산하 의생명연구소의 미생물 연구자이다.
구강미생물에서 시작해 장내 미생물, 발효 음식의 미생물까지 폭넓게 공부하며 몇 권의 책을 냈고 논문을 발표했다.
『미생물과의 공존』 『입속에서 시작하는 미생물이야기』 『미생물과 공존하는 나는 통생명체다』등 3권이 과학기술부 선정 우수과학도서를 수상했다.
장누수증후군(Leaky gut syndrome)을 들어보셨나요? 말 그대로 장세포에 균열이 생겨 장내부를 타고 항문으로 향하던 여러 미생물과 독소들이 더 깊은 내 몸으로 침투하여 전신적으로 돌며 여러 문제를 일으킨다는 겁니다. 장누수증후군의 옹호자들은, 이유 없이 피곤하거나 몸 여러 곳에 염증이 자주 생긴다거나 할 때 장누수증후군을 생각해 보라 권합니다. 심지어 암이나 심혈관질환처럼 생명을 위협하는 여러 질환도 장누수증후군에서 그 원인을 찾기도 하고요.
장이 누수가 되었다(Leaky gut)는 것은 우리가 일상에서 쉽게 접할 수 있습니다. 변비가 생기면 얼굴에 뾰루지가 납니다. 장과 얼굴은 꽤 멀리 있는데, 경험적으로 보면 원인 결과가 유추됩니다. 항문을 통해 나가야 할 변이 대장에 저류되어 있다면, 내 몸의 미생물 부담(bacterial burden)은 대폭 올라갈 테고, 그래서 대장세균이나 그 독소들이 장누수를 타고 혈관을 거쳐 얼굴에 영향을 미쳤다는 논리가 가능합니다. 꼭 변비가 아닌 정상범위의 미생물 부담 상태라도 진통소염제처럼 장세포를 자극하여 장세포 간 결합의 균열이 커진다면, 역시 장누수증후군이 될 수 있을 겁니다.
애초에, 영양학자나 대체의학을 하는 분들에 의해 주장되던 장누수증후군에 대해 주류의학은 대체적으로 회의적인 분위기였습니다. 직접적인 인과관계가 분명치 않다는 이유죠. 그런데, 장누수증후군에 대한 회의적 평가는 최근 들어 반전의 조짐을 보입니다. 내 몸, 특히 내 장내에는 거의 100조에 달하는 정상적인 상주세균이 늘 살고 있고, 이들과의 긴장과 평화가 내 몸 건강에 중요한 변수라는 인식이 확장되고 있기 때문이죠.
장내세균과 적절한 균형을 이루려면, 장 내부(lumen)를 내 몸 전체와 분리하여 장을 통과하는 여러 물질들이 더 이상 내 몸을 침투하지 못하게 하는 장세포의 방어막의 기능(barrier function)이 중요할 겁니다. 그래서, 이젠 주류의학도 용어는 조금 다르긴 하지만(increased intestinal permeability) 장누수증후군과 대동소이한 병인론으로 염증성 장염을 비롯한 여러 질환을 설명합니다. (Michielan and D'Incà 2015)
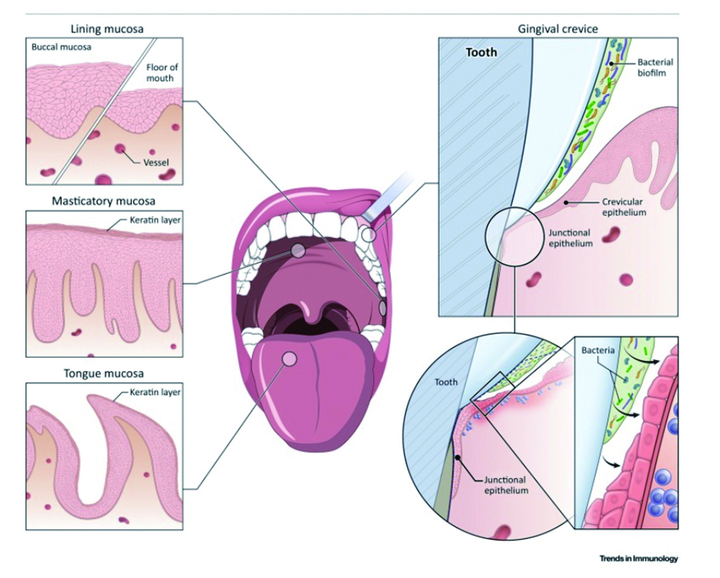
그런데, 이런 장에서보다 누수가 더 잘 일어나는 곳이 있습니다. 바로 구강입니다. 그중에서도 치주포켓 하방의 결합상피(junctional epithelium)가 그 부분입니다. 치주포켓 아래에서 치질과 잇몸상피를 접착하는 결합상피는 길이로 보면 약 1mm 이고, 세포 수준으로 보면 3~4개의 세포층으로 이루어져 있습니다. 문제는 이 결합상피간의 결합이 피부세포나 장세포 간의 결합보다 더 느슨하다는 점입니다.
상피 안쪽의 결합조직에 머물며 상피조직 안을 뚫고 더 안으로 들어오는 세균이나 독소를 먹어 치우려 순찰을 돌고 있는 백혈구들마저도 오고 갈 정도니까요. 보통 장세포 간 결합도 5 À 정도 크기의 물질은 통과시켜 영양소를 우리 몸이 흡수하게도 하긴 하지만, 구강의 결합상피 세포 간 결합은 수십 μ 크기인 백혈구마저 통과시킬 정도이니 그 누수의 정도가 어마어마한 크기 차이가 아닐 수 없습니다. 그래서 늘 신체조직 내부에 머무는 백혈구가 신체조직 외부인 치은열구액에도 발견되는데, 이는 매우 특이한 현상이 아닐 수 없습니다.(Moutsopoulos and Konkel 2018)
더 문제는 이 결합상피와 치아 간의 결합에 있습니다. 결합상피의 현미경적 구조는, 상피 쪽에서는 결합단백질을 만들어 치아와 결합하려 하지만, 이미 경화된 치아 쪽 세포에서는 결합단백질을 만들지 못합니다. 그래서 보통 세포 간의 정상적인 결합인 desmosome에다가 반쪽(hemi)이라는 접두어를 붙여 hemidesmosome이라 부릅니다. 보통 헤미데스모좀은 상피조직 전체와 그 아래 조직(basal layer) 간의 결합 위치에서 발견되는데 치아와 결합상피 간의 결합 역시 헤미데스모좀이라 매우 특이하지 않을 수 없습니다.
이렇게 치은열구 아래쪽 결합상피에서 상피세포 간, 상피세포와 치아 간 결합이 약하다는 것은, 그만큼 외부에 결합이 뚫릴 수 있는 여지가 크다는 것을 의미합니다. 말 그대로 잇몸누수증후군(leaky gum syndrome) 의 가능성이지요. 진료실에서는 이를 늘 접합니다. 치주조직이나 사랑니 주위에 생긴 염증이 얼굴 하방에 커다란 부종(abscess)을 만드는 경우를 흔히 봅니다. 치주포켓, 혹은 치은열구에 머물며 바이오필름을 만들었던 세균들이, 방어벽 기능이 낮은 결합상피를 뚫고 더 깊은 곳으로 침투하여 염증을 일으키는 겁니다. 상피세포 간 결합이 치밀한 피부염증에서는 흔히 보기 어려운 장면입니다.
잇몸누수는 꼭 이렇게 눈에 보이는 급성염증이 아니라도, 최근 들어 만병의 원인으로 지목되고 있는 저도전신염증(low grade systemic inflammation)의 원인 제공자일 수도 있습니다. 구강 내 세균은 언제든 전신적으로 침투할 수 있으니까요. 실제로 세균이 혈관으로 침투하는 균혈증(bacteremia)은 스케일링을 비롯한 가벼운 치과치료는 물론, 칫솔질이나 음석섭취를 하는 경우에도 일어날 수 있습니다.(Forner, Larsen et al. 2006)
20세기 초반에 의학 전체에서 상당한 각광을 받았던 focal infection theory가 최근 들어 다시 주목받기 시작한 것도 같은 맥락으로 보입니다. 충치나 치근단염이 여러 전신질환의 원인이라며 몸이 아프면 발치를 권유하던 시대는 더 이상 오지 않아야 합니다.
대신, 치주질환이 여러 전신적 문제를 가져오기에 구강위생관리가 중요하다고 얘기하는 치주의학(periodontal medicine) 은 진지한 고려의 대상이 되어야 합니다. 마치 장누수증후군이 increased intestinal permeability란 용어로 재탄생하듯이, focal infection theory도 periodontal medicine으로 재탄생 중에 있어 보입니다.(Kumar 2017, Beck, Papapanou et al. 2019)
Beck, J., et al. (2019). "Periodontal medicine: 100 years of progress." 98(10): 1053-1062.
Forner, L., et al. (2006). "Incidence of bacteremia after chewing, tooth brushing and scaling in individuals with periodontal inflammation." Journal of Clinical Periodontology 33(6): 401-407.
Kumar, P. S. (2017). "From focal sepsis to periodontal medicine: a century of exploring the role of the oral microbiome in systemic disease." The Journal of physiology 595(2): 465-476.
Michielan, A. and R. D'Incà (2015). "Intestinal Permeability in Inflammatory Bowel Disease: Pathogenesis, Clinical Evaluation, and Therapy of Leaky Gut." Mediators of Inflammation 2015: 628157-628157.
The pathogenesis of inflammatory bowel disease (IBD) is multifactorial with data suggesting the role of a disturbed interaction between the gut and the intestinal microbiota. A defective mucosal barrier may result in increased intestinal permeability which promotes the exposition to luminal content and triggers an immunological response that promotes intestinal inflammation. IBD patients display several defects in the many specialized components of mucosal barrier, from the mucus layer composition to the adhesion molecules that regulate paracellular permeability. These alterations may represent a primary dysfunction in Crohn's disease, but they may also perpetuate chronic mucosal inflammation in ulcerative colitis. In clinical practice, several studies have documented that changes in intestinal permeability can predict IBD course. Functional tests, such as the sugar absorption tests or the novel imaging technique using confocal laser endomicroscopy, allow an in vivo assessment of gut barrier integrity. Antitumor necrosis factor-α (TNF-α) therapy reduces mucosal inflammation and restores intestinal permeability in IBD patients. Butyrate, zinc, and some probiotics also ameliorate mucosal barrier dysfunction but their use is still limited and further studies are needed before considering permeability manipulation as a therapeutic target in IBD.
Moutsopoulos, N. M. and J. E. Konkel (2018). "Tissue-Specific Immunity at the Oral Mucosal Barrier." Trends in immunology 39(4): 276-287.
The oral mucosal barrier is constantly exposed to a plethora of triggers requiring immune control, including a diverse commensal microbiome, ongoing damage from mastication, and dietary and airborne antigens. However, how these tissue-specific cues participate in the training of immune responsiveness at this site is minimally understood. Moreover, the mechanisms mediating homeostatic immunity at this interface are not yet fully defined. Here we present basic aspects of the oral mucosal barrier and discuss local cues that may modulate and train local immune responsiveness. We particularly focus on the immune cell network mediating immune surveillance at a specific oral barrier, the gingiva – a constantly stimulated and dynamic environment where homeostasis is often disrupted, resulting in the common inflammatory disease periodontitis.